【行业】CAR-T 细胞治疗,血液肿瘤大放异彩(30页)
免疫疗法:开启肿瘤治疗的新时代。肿瘤免疫治疗是指应用免疫学原理和方法,提高肿瘤细胞的免疫原性,激发和增强机体抗肿瘤免疫应答,从而抑制肿瘤的生长。由于其毒副作用小、疗效明显等特点,肿瘤免疫治疗有望成为继手术、化疗、放疗和靶向治疗后,肿瘤治疗领域的一场革新。肿瘤免疫疗法目前包括细胞因子、肿瘤疫苗、过继性细胞治疗、溶瘤病毒、免疫检查点阻断几种主要的治疗方法。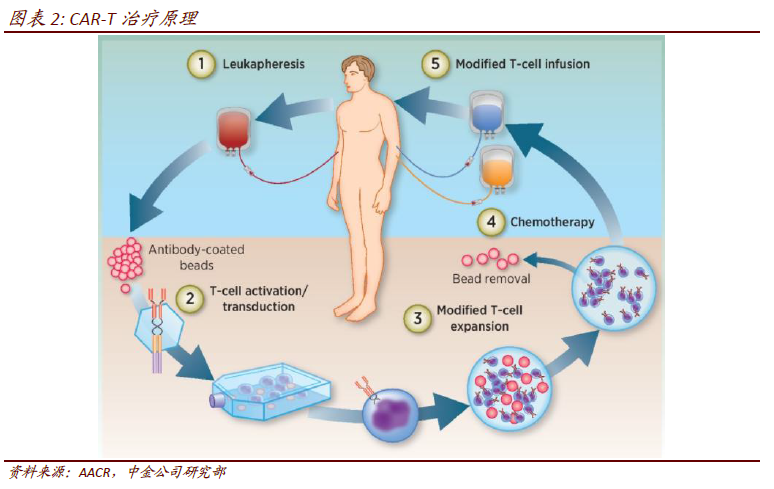 CAR-T 细胞治疗:不受MHC 分子限制,肿瘤识别和杀伤更高效。细胞免疫疗法主要指过继性细胞治疗(ACT),可分为非特异性和特异性,前者包括NK、CIK等,后者包括DC-CIK、TCR-T、CAR-T 等。CAR-T 疗法(Chimeric Antigen Receptor T-Cellimmunotherapy)全称嵌合抗原受体T 细胞免疫疗法,其原理是将病人体内取得的T 细胞,用基因工程的方法经激活、转染、修饰、扩增后,重新注射到病人体内,通过激发人体自身的免疫系统来消灭肿瘤。
CAR-T 细胞治疗:不受MHC 分子限制,肿瘤识别和杀伤更高效。细胞免疫疗法主要指过继性细胞治疗(ACT),可分为非特异性和特异性,前者包括NK、CIK等,后者包括DC-CIK、TCR-T、CAR-T 等。CAR-T 疗法(Chimeric Antigen Receptor T-Cellimmunotherapy)全称嵌合抗原受体T 细胞免疫疗法,其原理是将病人体内取得的T 细胞,用基因工程的方法经激活、转染、修饰、扩增后,重新注射到病人体内,通过激发人体自身的免疫系统来消灭肿瘤。 相比于TCR-T 细胞治疗,CAR-T 不需要识别MHC 分子。由于CAR-T 克服了MHC 的限制性,可更有效的杀伤抗原特异性的肿瘤细胞,减少了由于肿瘤降低MHC 分子表达而造成的免疫逃逸,同时具备抗原抗体结合特异性好、亲和力高的优势。此外由于打破病人对于MHC 的限制后,CAR 改造的T 细胞相对于天然T 细胞表面受体TCR 能识别更广泛的目标。
相比于TCR-T 细胞治疗,CAR-T 不需要识别MHC 分子。由于CAR-T 克服了MHC 的限制性,可更有效的杀伤抗原特异性的肿瘤细胞,减少了由于肿瘤降低MHC 分子表达而造成的免疫逃逸,同时具备抗原抗体结合特异性好、亲和力高的优势。此外由于打破病人对于MHC 的限制后,CAR 改造的T 细胞相对于天然T 细胞表面受体TCR 能识别更广泛的目标。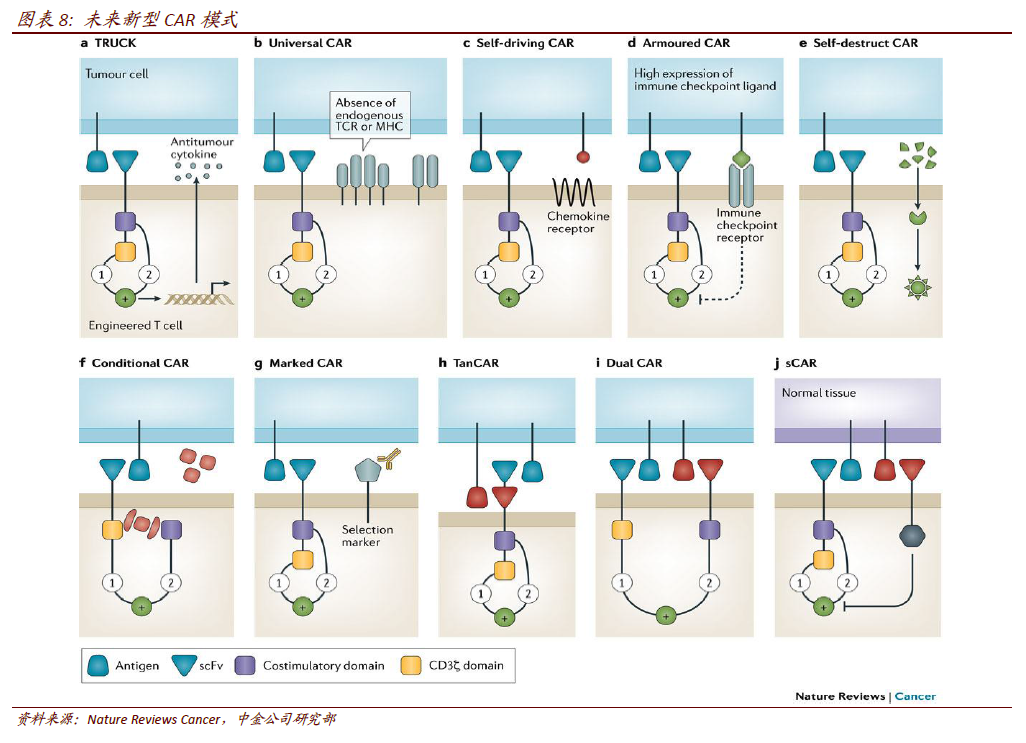 三代CAR 的区别。CAR 由胞外区、跨膜区和胞内区三个部分组成,其本质上是由不同蛋白功能结构域串联形成的膜蛋白。胞外区通常是分离自抗原特异性单克隆抗体的scFv 片段,胞内是T 细胞活化的分子,如CD3ζ、FcRγ、CD28 或者41BB、FcRγ。第一代CAR 只有一个胞内信号组份,主要是CD3ζ或FcRγ,T 细胞可以被活化但无法增殖。第二代CAR具有两个胞内信号组份,包括一个共刺激分子,如CD28、41BB 等。第三代CAR 具有三个胞内信号域,包括两个串联的共刺激域CD28、41BB 或OX40 和一个CD3ζ。目前研究表明三代CAR 使细胞具备更强的肿瘤裂解能力和分泌更多的细胞因子,在小鼠体内具有更强的肿瘤抑制能力。
三代CAR 的区别。CAR 由胞外区、跨膜区和胞内区三个部分组成,其本质上是由不同蛋白功能结构域串联形成的膜蛋白。胞外区通常是分离自抗原特异性单克隆抗体的scFv 片段,胞内是T 细胞活化的分子,如CD3ζ、FcRγ、CD28 或者41BB、FcRγ。第一代CAR 只有一个胞内信号组份,主要是CD3ζ或FcRγ,T 细胞可以被活化但无法增殖。第二代CAR具有两个胞内信号组份,包括一个共刺激分子,如CD28、41BB 等。第三代CAR 具有三个胞内信号域,包括两个串联的共刺激域CD28、41BB 或OX40 和一个CD3ζ。目前研究表明三代CAR 使细胞具备更强的肿瘤裂解能力和分泌更多的细胞因子,在小鼠体内具有更强的肿瘤抑制能力。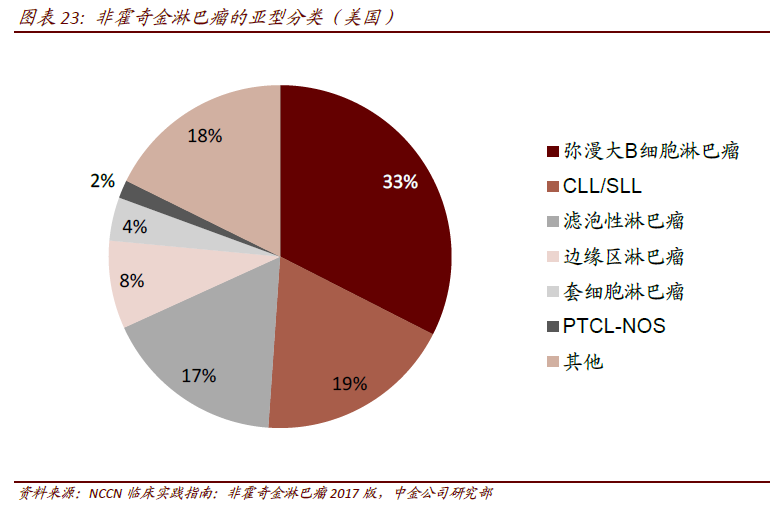 CD19 靶向的CAR-T 细胞在B细胞恶性肿瘤的治疗中表现惊艳。在已有的CAR-T 治疗中来看,靶向CD19 的CAR-T 细胞研究的最多也最成熟。全球范围来看,已有多项CD19 靶向的二代CAR(CD28/CD3ζ)和三代CAR(CD28/CD3ζ/41BB)开展对非霍奇金淋巴瘤(NHL)、B-All(急性B 淋巴细胞白血病)、慢性淋巴细胞白血病(CLL)、滤泡性淋巴瘤(FL)、弥漫性大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)等血液肿瘤的临床试验,且表现出优异的疗效。以r/r B-All 为例,病人的完全应答率多为70~90%。2017 年ASCO 会议上,CAR-T 用于r/r MM(多发性骨髓瘤)中也取得令人瞩目的效果,94%(33/35)患者在CAR-T 细胞输注后2 个月内获得了VGPR。CAR-T 细胞治疗的出现,为晚期血液肿瘤患者带来新的希望。
CD19 靶向的CAR-T 细胞在B细胞恶性肿瘤的治疗中表现惊艳。在已有的CAR-T 治疗中来看,靶向CD19 的CAR-T 细胞研究的最多也最成熟。全球范围来看,已有多项CD19 靶向的二代CAR(CD28/CD3ζ)和三代CAR(CD28/CD3ζ/41BB)开展对非霍奇金淋巴瘤(NHL)、B-All(急性B 淋巴细胞白血病)、慢性淋巴细胞白血病(CLL)、滤泡性淋巴瘤(FL)、弥漫性大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)等血液肿瘤的临床试验,且表现出优异的疗效。以r/r B-All 为例,病人的完全应答率多为70~90%。2017 年ASCO 会议上,CAR-T 用于r/r MM(多发性骨髓瘤)中也取得令人瞩目的效果,94%(33/35)患者在CAR-T 细胞输注后2 个月内获得了VGPR。CAR-T 细胞治疗的出现,为晚期血液肿瘤患者带来新的希望。
 CAR-T 细胞治疗:不受MHC 分子限制,肿瘤识别和杀伤更高效。细胞免疫疗法主要指过继性细胞治疗(ACT),可分为非特异性和特异性,前者包括NK、CIK等,后者包括DC-CIK、TCR-T、CAR-T 等。CAR-T 疗法(Chimeric Antigen Receptor T-Cellimmunotherapy)全称嵌合抗原受体T 细胞免疫疗法,其原理是将病人体内取得的T 细胞,用基因工程的方法经激活、转染、修饰、扩增后,重新注射到病人体内,通过激发人体自身的免疫系统来消灭肿瘤。
CAR-T 细胞治疗:不受MHC 分子限制,肿瘤识别和杀伤更高效。细胞免疫疗法主要指过继性细胞治疗(ACT),可分为非特异性和特异性,前者包括NK、CIK等,后者包括DC-CIK、TCR-T、CAR-T 等。CAR-T 疗法(Chimeric Antigen Receptor T-Cellimmunotherapy)全称嵌合抗原受体T 细胞免疫疗法,其原理是将病人体内取得的T 细胞,用基因工程的方法经激活、转染、修饰、扩增后,重新注射到病人体内,通过激发人体自身的免疫系统来消灭肿瘤。 相比于TCR-T 细胞治疗,CAR-T 不需要识别MHC 分子。由于CAR-T 克服了MHC 的限制性,可更有效的杀伤抗原特异性的肿瘤细胞,减少了由于肿瘤降低MHC 分子表达而造成的免疫逃逸,同时具备抗原抗体结合特异性好、亲和力高的优势。此外由于打破病人对于MHC 的限制后,CAR 改造的T 细胞相对于天然T 细胞表面受体TCR 能识别更广泛的目标。
相比于TCR-T 细胞治疗,CAR-T 不需要识别MHC 分子。由于CAR-T 克服了MHC 的限制性,可更有效的杀伤抗原特异性的肿瘤细胞,减少了由于肿瘤降低MHC 分子表达而造成的免疫逃逸,同时具备抗原抗体结合特异性好、亲和力高的优势。此外由于打破病人对于MHC 的限制后,CAR 改造的T 细胞相对于天然T 细胞表面受体TCR 能识别更广泛的目标。 三代CAR 的区别。CAR 由胞外区、跨膜区和胞内区三个部分组成,其本质上是由不同蛋白功能结构域串联形成的膜蛋白。胞外区通常是分离自抗原特异性单克隆抗体的scFv 片段,胞内是T 细胞活化的分子,如CD3ζ、FcRγ、CD28 或者41BB、FcRγ。第一代CAR 只有一个胞内信号组份,主要是CD3ζ或FcRγ,T 细胞可以被活化但无法增殖。第二代CAR具有两个胞内信号组份,包括一个共刺激分子,如CD28、41BB 等。第三代CAR 具有三个胞内信号域,包括两个串联的共刺激域CD28、41BB 或OX40 和一个CD3ζ。目前研究表明三代CAR 使细胞具备更强的肿瘤裂解能力和分泌更多的细胞因子,在小鼠体内具有更强的肿瘤抑制能力。
三代CAR 的区别。CAR 由胞外区、跨膜区和胞内区三个部分组成,其本质上是由不同蛋白功能结构域串联形成的膜蛋白。胞外区通常是分离自抗原特异性单克隆抗体的scFv 片段,胞内是T 细胞活化的分子,如CD3ζ、FcRγ、CD28 或者41BB、FcRγ。第一代CAR 只有一个胞内信号组份,主要是CD3ζ或FcRγ,T 细胞可以被活化但无法增殖。第二代CAR具有两个胞内信号组份,包括一个共刺激分子,如CD28、41BB 等。第三代CAR 具有三个胞内信号域,包括两个串联的共刺激域CD28、41BB 或OX40 和一个CD3ζ。目前研究表明三代CAR 使细胞具备更强的肿瘤裂解能力和分泌更多的细胞因子,在小鼠体内具有更强的肿瘤抑制能力。 CD19 靶向的CAR-T 细胞在B细胞恶性肿瘤的治疗中表现惊艳。在已有的CAR-T 治疗中来看,靶向CD19 的CAR-T 细胞研究的最多也最成熟。全球范围来看,已有多项CD19 靶向的二代CAR(CD28/CD3ζ)和三代CAR(CD28/CD3ζ/41BB)开展对非霍奇金淋巴瘤(NHL)、B-All(急性B 淋巴细胞白血病)、慢性淋巴细胞白血病(CLL)、滤泡性淋巴瘤(FL)、弥漫性大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)等血液肿瘤的临床试验,且表现出优异的疗效。以r/r B-All 为例,病人的完全应答率多为70~90%。2017 年ASCO 会议上,CAR-T 用于r/r MM(多发性骨髓瘤)中也取得令人瞩目的效果,94%(33/35)患者在CAR-T 细胞输注后2 个月内获得了VGPR。CAR-T 细胞治疗的出现,为晚期血液肿瘤患者带来新的希望。
CD19 靶向的CAR-T 细胞在B细胞恶性肿瘤的治疗中表现惊艳。在已有的CAR-T 治疗中来看,靶向CD19 的CAR-T 细胞研究的最多也最成熟。全球范围来看,已有多项CD19 靶向的二代CAR(CD28/CD3ζ)和三代CAR(CD28/CD3ζ/41BB)开展对非霍奇金淋巴瘤(NHL)、B-All(急性B 淋巴细胞白血病)、慢性淋巴细胞白血病(CLL)、滤泡性淋巴瘤(FL)、弥漫性大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)等血液肿瘤的临床试验,且表现出优异的疗效。以r/r B-All 为例,病人的完全应答率多为70~90%。2017 年ASCO 会议上,CAR-T 用于r/r MM(多发性骨髓瘤)中也取得令人瞩目的效果,94%(33/35)患者在CAR-T 细胞输注后2 个月内获得了VGPR。CAR-T 细胞治疗的出现,为晚期血液肿瘤患者带来新的希望。




